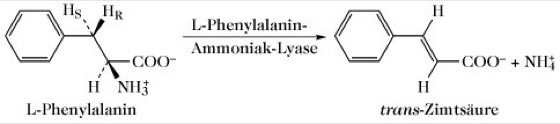
Die Phenylalanin-Ammoniak-Lyase (PAL) ist ein Enzym, welches hauptsächlich in Eukaryoten und Bakterien vorkommt. PAL wandelt die Aminosäure Phenylalanin unter Freisetzung von Ammoniak (NH3) zu Zimtsäure um. Dies ist der erste Schritt in der Biosynthese der Phenylpropanoide. PAL ist eines von zwei Enzymen mit der Aminosäure Dehydroalanin.
Da Phenylalanin ein Produkt des Primärstoffwechsels der Pflanze ist und durch die Bildung von Zimtsäure aus dem Primärstoffwechsel entfernt wird, unterliegt die Biosynthese von PAL sowie deren Aktivität der Kontrolle von z. B. Licht (über das Phytochromsystem) und anderen Faktoren. Die PAL wird beispielsweise bei Verwundung der Pflanze aktiviert, wahrscheinlich um die Synthese sekundärer Pflanzenstoffe anzuregen.
Das Enzym wird meist durch drei oder vier Gene codiert, d. h. in vielen Pflanzen existieren mehrere paraloge Isoformen.
Einzelnachweise